Genel Kimya 1 Dersi 2. Ünite Özet
Kimyasal Tepkimeler Ve Stokiyometri
Kimyasal Tepkimeler ve Denklemler
Bir veya birkaç saf maddenin belli koşullarda kimyasal değişime (kimyasal bağlardaki değişme) uğrayarak başka madde veya maddelere dönüşmesine kimyasal tepkime denir.
Kimyasal Tepkimelerin Sınıflandırılması
Kimyasal tepkimeler dört ana grupta toplanabilir
Sentez Tepkimeleri: Bu tepkimelerde, iki veya daha fazla element veya bileşik bir araya gelerek, yeni bileşik oluştururlar.
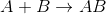
Ayrışma (Bozunma) Tepkimeleri: Bu tepkimelerde, sentez tepkimelerinin tersine bir bileşik yeni bileşiklere ve/veya elementlere ayrışır.
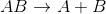
Yer Değiştirme Tepkimeleri: Bir bileşikteki bazı atom veya grupların, bir başka bileşikteki atom veya gruplar ile yer değiştirmesi tepkimeleridir.
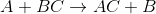
İyonik Tepkimeler: Sulu çözeltilerde iyonik türler arasında gerçekleşen bu tepkimelerde, zıt yüklü iyon çiftleri bir araya gelerek çökelek oluşturabilirler, gaz çıkışına neden olabilirler veya iyonik olmayan başka bileşikler oluşturabilirler.
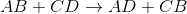
Kimyasal Tepkime Denklemlerinin Yazılması
Bir kimyasal tepkimenin ifadesi kimyasal denklemdir. Bir kimyasal denklem, gerçekleşen tepkime ile ilgili çeşitli bilgiler verir ve bu bilgilerin doğru değerlendirilmesiyle ilgili tepkimenin hangi maddeler arasında olduğu, tepkimenin hangi koşullarda gerçekleştiği gibi önemli bilgiler edinilebilir. Bir kimyasal denklem basitçe, tepkimede kullanılan tepken lerden (reaktant, tepkimeye girenler) ve oluşan ürün lerden (tepkimeden çıkanlar) meydana gelen şematik bir ifadedir.
- Denklemde tepkenler sola, ürünler sağa yazılır. Birden fazla tepken ve ürün var ise aralarına “+” işareti konulur.
- Tepkimenin tipini belirtmek üzere tepken ve ürünler arasına bir ok konulur. Tek yönlü ok, tepkimenin tek yönlü ve ürünler yönüne doğru tamamlanan bir tepkime olduğunu gösterirken, çift yönlü ok, tepkimenin bir denge tepkimesi olduğunu ve tepkenler ürünlere dönüşürken, ürünlerin de tepkenlere dönüştüğünü gösterir.
- Tepken ve ürünlerin hangi fiziksel halde olduklarını göstermek üzere;(k): katı, (s): sıvı, (g): gaz, (sulu): sulu çözelti gösterimleri tepkime denklemlerindeki tepken ve ürünlerin formüllerinin yanına yazılır.
- Tepkimenin hangi koşullarda olduğu tepkime okunun üzerine yazılır. Tepkime sıcaklığı, süresi ve/veya çözücüsü gibi bilgiler ok işareti üzerine yazılabilir.
- Kimyasal tepkime denklemleri kütlenin korunumu yasasına göre denkleştirilir
Kimyasal Denklemlerin Denkleştirilmesi
Kütlenin korunumu yasasına göre bir kimyasal tepkimede, tepkimeye giren maddelerin (tepkenlerin) kütlelerinin toplamı, tepkimeden çıkan maddelerin (ürünlerin) kütlelerinin toplamına eşittir. Bir tepkime denklemi, tepken ve ürünlerin hangi oranlarda birleştiğini gösteren stokiyometrik katsayılar yazılarak denkleştirilir.
Bir tepkimenin denkleştirilmesi için
- Tepkime denkleminin her iki tarafındaki her bir elemente ait atomlar ayrı ayrı sayılır.
- Tepkime denkleminin denkleştirilmesinde elementel haldeki (C, H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 , I 2 , Cu, Hg, Fe gibi) tepken veya ürünlerin stokiyometrik katsayıları en son belirlenir. Dolayısıyla tepkime denklemini denkleştirmeye bileşiklerden başlamak kolaylık sağlar.
- Denkleştirmede başlangıçta, kesirli sayılar kullanılabilir, ancak denkleştirme tamamlandıktan sonra, denklemi kesirli sayılardan kurtarmak için tepkimedeki stokiyometrik katsayıların tümü uygun bir sayı ile çarpılır.
- Denklem denkleştirmek için tepkenlerin ve ürünlerin nitelikleri veya türleri asla değiştirilemez. Yani, bir tepkime denklemi denkleştirmek için tepkime denklemine, tepkimenin tepkeni veya ürünü olmayan bir maddeyi asla yazmayınız.
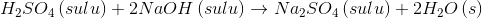
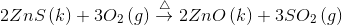
Atom Kütlesi
Atom kütlesi için bağıl bir ölçek kullanılır. Uluslararası kabul sonucu, atom kütle standardı için karbon atomu seçilmiş ve bu izotopun atom kütlesi 12 atom kütle birimi (akb) olarak kabul edilmiştir. Bu kabule bağlı olarak, 1 atom kütle birimi, 1 tane karbon-12 atomunun kütlesinin 1/12 i olarak tanımlanmıştır.
1 akb = 1,6606 x 10 -24 g
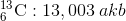
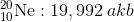
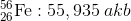
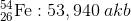
Bir element farklı atom ağırlıklarına sahip izotopları (atom numaraları aynı, nötron sayılarının farklı olmasıyla kütle numaraları birbirinden farklı olan izotop atomlar.) farklı kütlelere sahiptir ve her bir izotop doğada birbirlerinden farklı miktarda (oranda) bulunabilir. Bu nedenle bir atomun atom kütlesi tüm izotop atomları göz önünde bulundurularak ortalama atom kütlesi hesaplanabilir. Ortalama atom kütlesi, elementi oluşturan izotopların kütlelerinin bağıl bolluk kesirleriyle çarpılıp toplanmasıyla elde edilir.
Ortalama atom kütlesi = [(izotop-1 in kütlesi) x (izotop1 in bağıl kesri)] + [(izotop-2’nin kütlesi) x (izotop-2’nin bağıl kesri)] + [(izotop-3’ün kütlesi) x (izotop3’ün bağıl kesri)] + …..
Mol Kavramı ve Avogadro Sayısı
Tam olarak 12 gram karbon-12 izotopu içeren bir örnekte, 6,02214179 x 1023 tane atom bulunur ve bu sayıya Avogadro sayısı (N A ) denir.
1 mol maddenin kütlesine, mol kütlesi (M A ) denir ve mol kütlesinin birimi g/mol dür. Bir atom veya molekülün mol sayısı (n) , kütlesinin (m) mol kütlesine (M A ) bölünmesiyle hesaplanır. Bir bileşiğin mol kütlesi ise bileşiği oluşturan atomların mol kütlelerinin toplanmasıyla bulunur. Bir atom veya molekülün mol sayısı (n), kütlesinin (m) mol kütlesine (M A ) bölünmesiyle hesaplanır. Diğer yandan, bir bileşiğin mol kütlesi , bileşiği oluşturan atomların mol kütlelerinin toplanmasıyla bulunur.
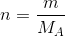
Bir bileşiğin mol sayısı biliniyorsa, Avogadro sayısı yardımıyla bileşiği oluşturan molekül sayısı ve mol kütlesi (MA) yardımıyla kütlesi (m) hesaplanabilir. Bu ilişkiye kütle-mol-tanecik sayısı ilişkisi denilir.
Kimyasal Formüllerin Belirlenmesi
Sabit oranlar yasasına göre; elementler, bileşikleri oluşturmak üzere bir araya geldiklerinde kütleleri arasında sabit bir oran vardır. Bir bileşiğin bulunan formülü, o bileşiğin bir biriminde bulunan atomların sayısını verir. Bir bileşiğin formülünü bulmak için genellikle kütle yüzdesi nden faydalanılır ve kütle yüzdeleri deneysel olarak belirlenir.
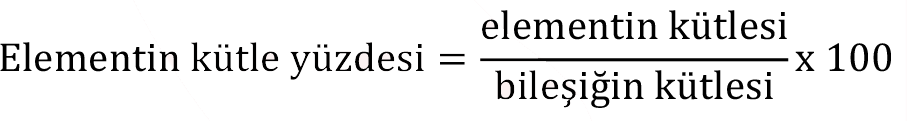
Basit Formüllerin Belirlenmesi
Bir bileşiğin kimyasal formülünü belirlemek için, çeşitli deneysel yöntemlerle önce bileşiği oluşturan atomların türleri ve kütle yüzdeleri saptanır. Bu kütle yüzdeleri, mol sayılarına çevrilerek bileşikte her bir atomdan kaç mol olduğu bulunur. Bulunan bu mol sayıları çoğunlukla kesirli değerlerdir ve bu kesirli değerleri tam sayılara çevirmek için her bir değer en küçük kesirli değere bölünür. Bu şekilde elde edilen değerler atomların bileşikte, hangi oranlarda birleştiğini gösteren değerler olup bileşiğin basit (deneysel) formülünü belirlememizi sağlar. Basit formül, bileşiği oluşturan atomların türü ve birbirlerine göre oranları hakkında bilgi verirken; daha sonra göreceğimiz molekül formülü, bileşiği oluşturan atomların türü ve gerçek sayıları hakkında bilgi verir.
Molekül Formüllerinin Belirlenmesi
Basit formülün mol kütlesi hesaplanmasından sonra bileşiğin deneysel olarak saptanmış mol kütlesiyle oranlanır, böylece iki kütle arasındaki ilişki rakamsal olarak saptanır.
Yakma Analizi
Yakma analizinde organik esaslı (C, H, N, O, S içeren) bir bileşik yüksek sıcaklıkta yakılır, yani oksijen ile tepkimeye sokulur. Böylece bileşiğin yapısındaki karbon (C) karbon dioksite (CO 2 ), hidrojen (H) suya (H 2 O) dönüştürülür ve bazı özel düzeneklerde toplandıktan sonra miktarları tespit edilir. Bu yöntemde yakma işlemi sırasında oksijen gazı (O 2 ) kullanıldığından, molekülün yapısındaki oksijenin (O) miktarı bu yöntemle doğrudan belirlenemez.
Stokiyometri
Bir tepkimedeki tüm bileşenler (tepkenler ve ürünler) arasındaki mol, kütle veya hacim cinsinden madde miktarı ilişkisine stokiyometri denir.
Kütle - Mol - Kütle İlişkisi
Stokiyometrik katsayılar, önlerinde oldukları bileşiklerin tepkimedeki mol sayılarını da belirttikleri için tepkimedeki tepkenlerin ve ürünlerin miktarlarının hesaplanabilmesini de sağlarlar.
Sınırlayıcı bileşen , bir tepkimede ilk harcanan tepkendir ve bu sınırlayıcı tepkenin reaksiyon sırasında tükenmesi sonucu tepkimenin sonlanması gerçekleşir. Bu nedenle, sınırlayıcı bileşen tepkime sonunda oluşacak ürünlerin miktarını da belirler.
Tepkime verimi ise, deneysel ürün miktarı ile teorik ürün miktarı arasındaki ilişkiyi ortaya koyar. Teorik verimde, tepkimenin %100 verimle gerçekleştiği ve sınırlayıcı tepkenin tamamının kullanıldığı varsayılır. Gerçek verim ise tepkime sonunda gerçekte elde edilendir. Bir tepkimenin verimi genellikle % verim olarak belirlenir ve aşağıdaki gibi hesaplanır.

-
2025-2026 Bahar Dönemi Ara (Vize) Sınavı İçin Sınav Merkezi Tercihi
date_range 11 Şubat 2026 Çarşamba comment 9 visibility 967
-
AÖF 2025-2026 Öğretim Yılı Bahar Dönemi Kayıt Yenileme Duyurusu
date_range 1 Şubat 2026 Pazar comment 1 visibility 488
-
2025-2026 Öğretim Yılı Güz Dönemi Ara (Vize) Sınavı Sonuçları Açıklandı!
date_range 16 Aralık 2025 Salı comment 4 visibility 1024
-
2025-2026 Güz Dönemi Dönem Sonu (Final) Sınavı İçin Sınav Merkezi Tercihi
date_range 3 Aralık 2025 Çarşamba comment 2 visibility 1006
-
2025-2026 Güz Dönemi Ara (Vize) Sınavı Sınav Bilgilendirmesi
date_range 2 Aralık 2025 Salı comment 2 visibility 844
-
Başarı notu nedir, nasıl hesaplanıyor? Görüntüleme : 26862
-
Bütünleme sınavı neden yapılmamaktadır? Görüntüleme : 15464
-
Harf notlarının anlamları nedir? Görüntüleme : 13676
-
Akademik durum neyi ifade ediyor? Görüntüleme : 13412
-
Akademik yetersizlik uyarısı ne anlama gelmektedir? Görüntüleme : 11201