Veteriner Laboratuvar Teknikleri ve Prensipleri Dersi 6. Ünite Özet
Laboratuvarda Kullanılan İleri Analiz Yöntemleri
- Özet
- Sorularla Öğrenelim
Elektroforez
Elektroforez, çeşitlilik arz eden ve iyonize olabilen analitlerin ayırımına yönelik çok yönlü ve güçlü analitik tekniktir. Yük taşıyan çözünmüş maddeler veya parçacıkların sıvı ortamda elektriksel alanın etkisiyle göç etmesi elektroforez tekniğinin kapsamını oluşturur. İyonoforez benzer bir terim olup sadece küçük iyonlar›n göç etmesini tarif eder.
İyonize olarak yüklenen kimyasal moleküller; taşıdıkları yüke göre elektroforez sisteminde ya anoda (artı elektrot) ya da katoda (eksi elektrot) göç ederler. Artı iyonlar (katyon) katoda, negatif iyonlar ise (anyon) anoda göç ederler. Artı ya da eksi yük taşıyabilen moleküller amfolit olarak anılır ve kendi izoelektrik noktalarından (pI) daha asidik ortamda bulunanlar artı yük alarak katoda göç ederler. Daha alkali ortamda ise eksi yüklenerek anoda göç ederler. Göç etme hızı; molekülün net yükü, molekülün büyüklüğü ve şekli, elektriksel alan şiddeti, destek materyalinin özelliği ve çalışma ısısı gibi faktörlerden etkilenir. Elektroforetik hareket (µ) her bir birim alan şiddeti (volt/cm) başına göç hızı (cm/s) olarak tanımlanır.
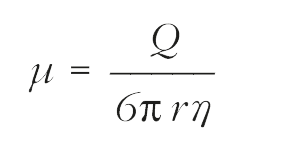
Denklemde;
µ = cm 2 /(V)(s) de elektroforetik hareketi
Q = iyonun net yükünü
r = çözünenin iyonik yarıçapını
? = göçün meydana geldiği tampon çözeltinin akışkanlığını belirtir.
Bu nedenle elektroforetik hareketlilik net yükle doğru, molekül büyüklük ve akışkanlık ile ters orantılıdır.
Elektroforez sisteminde kullanılan tamponu içeren alanda platin veya karbondan imal edilmiş elektrot bulunur. Pozitif veya negatif kutbun yükü, güç kaynağına bağlanma şekline göre belirlenir. Ayırımın gerçekleştiği ortam olan elektroforez desteği ya tampon ile doğrudan ya da fitiller ile dolaylı olarak temas eder. Cihaz, güç kaynağına doğrudan bağlı olduğu için personel ve sistemin korunması ve yüzeyden buharlaşmanın en aza indirilmesi amacıyla, uygun kapaklar kullanılarak kapatılır.Elektroforezler destek materyallerine göre dört tipe ayrılır. Bunlar;
- Kağıt Elektroforezi
- Nişasta Jel ve Selüloz Asetat Elektroforez
- Agaroz Jel Elektroforezi
- Poliakrilamid Jel Elektroforezi
Kromatografi
Kromatografi, birbiri ile yakın benzerliği ve ilişkileri olan analitlerin, ayrım ve miktarlarının belirlenmesine yönelik kullanılmaktadır. Çözünmüş haldeki maddelerin, hareketli faz ve sabit faz arasında farklılık gösteren dağılımlarına göre ayrılmasını kromatografik sistemler sağlar. Bu işlem sırasında hareketli faz aracılığıyla örnek, sabit fazı barındıran katman veya kolondan geçer. Mobil faz sabit faz üzerinden ilerledikçe, çözünen maddeler ya sabit faza tutunur ve hareket etmeyebilir veya sabit faza hiç tutunmadan mobil fazla beraber hareket edebilir. Diğer bir seçenekte ise örnek her iki faz ile birden etkileşir ve iki faz arasında dağılım gösterir. Sabit faza ilgisi daha çok olan analitler daha yavaş göç ederken, az olanlar daha hızlı hareket ederler. Analitlerin mobil faza ilgisi arttıkça göç etme hızı artar. Kuvvetli bağlanan analitler, sabit fazdan ancak mobil fazın kimyasal özelliği değiştirilerek ayrılabilirler. Kromatografi çeşitleri aşağıdaki gibi şematize edilebilir;
- Düzlemsel kromatografi
- Kağıt kromatografi
- İnce tabaka kromatografi
- Kolon kromatografi
- Gaz kromatografi
- Sıvı kromatografi
Düzlemsel kromatografide ayrılan alanlar ya kendine özgü renkler aracılığı ile ya da kimyasal değişiklik sonucu elde edilmiş renkli odaklar veya bantlar halinde görüntülenir. Bu sayede analitlerin niteliksel olarak tanınma analizi yapılabildiği gibi miktar analizi de yapılabilir. Kolon kromatografisinde ise tanımlama ve miktarlama bilgileri alıkonma zamanları ve pik alanlarından çıkarılabilmektedir.
Kromatografik ayırımın sınıflandırılması, çözünen maddelerin fiziksel veya kimyasal özelliklerine göre yapılmaktadır. Bunlar;
- İyon değişim
- Bölümleme (partisyon)
- Soğurma (adsorbsiyon)
- Boyut dışlama (jel filtrasyon)
- Affinite
kromatografileridir.
İmmunokimyasal teknikler
İmmunokimyasal reaksiyonlar, immunoassay olarak bilinen hassas ve özgül testlerin esasını oluşturmaktadır. Tipik bir immunoassayda analiti yani antijeni tanımak üzere, antikorlar ayıraç olarak kullanılmaktadır. Spesifik antijenlere karşı hazırlanmış yüksek özgüllük ve affinitedeki antikorların varlığı ve antikorların eşsiz bir biçimde antijenleri çapraz bağlama yeteneklerinin oluşu spesifik maddelerin tanınmasını ve miktarlarının belirlenmesini sağlamıştır.
Konak için yabancı olup; girdiğinde antikor cevabı oluşturan, antikor ile in vitro ve in vivo koşullarda reaksiyona giren kimyasal maddelere antijen denir. Bir antijene karşı üretilen ve onunla bağlanma yeteneğine sahip glikoprotein ise antikor adını alır. Kendisi antikor oluşturmayan ama mevcut antikorlar ile özgül olarak birleşen saf polisakkarit veya lipit moleküller ise haptendir. Taşıyıcı proteinler ile birleştiklerinde antijenik özellik kazanırlar. Monoklonal antikorlar, tek tip plazma hücresi tarafından üretilen ve ilgili antijenin sadece bir tek antijenik bölgesine (epitop) bağlanma yeteneğine sahip glikoproteinlerdir. Antijenin konağa verilmesi sonucu aynı antijenin farklı epitoplarına karşı farklı plazma hücreleri tarafından sentezlenen heterojen antikor karışımına poliklonal antikor denilmektedir.
İmmunotayin (immunoassay), kompleks karışım içinde bulunan bir analitin varlığı veya miktarını belirlemeye yarayan testtir. Serum veya idrar gibi biyolojik sıvılarda yer alan analitlerin ölçümü için immunotayin yöntemlerinden yararlanılmaktadır. Bu testlerde, sadece bir veya çok sınırlı kapsamda yer alan moleküle karşı bağlanma yeteneğine sahip antikorlar kullanılmaktadır. Antikora bağlanan molekül ise antijen olarak tanımlanmaktadır. İmmunotayin yöntemleri ya antijen ya da antikor düzeylerini belirlemeye yönelik olarak hazırlanabilir. Her iki durumda da; testin özgüllüğü, ilgilenilen moleküle karşı kullanılan bağlayıcı molekülün eşine bağlanırken diğer arzu edilmeyen molekülleri ne derece ayırt edebildiğine bağlıdır. Özgüllüğün yanında doğru ölçüm için affinitesi ve aviditesi yüksek moleküller kullanılmalıdır.
Kalitatif amaçlı kullanılan başlıca immunokimyasal yöntemler pasif jel difüzyon, immunelektroforez ve Western plottur. Pasif jel difüzyonun Oudin jel difüzyonu, Ouchterlony tekniği ve radial immunodifüzyon gibi farklı teknikleri mevcuttur.
ELISA, enzimle işaretli antijen ya da antikorun serbest antijen ya da antikor ile reaksiyona girmesi ve oluşan antijen antikor kompleksinin enzim aktivitesinin enzime spesifik substrat varlığında ortaya konması esasına dayanan ölçüm tekniğidir. Test polistren mikrotitrasyon plakalarında gerçekleştirilir. Plakalarda yer alan kuyucukları kaplamada antijen veya antikor çözeltileri kullanılır. İncelenen örnekler bu kuyucuklarda inkübe edilerek antijen-antikor kompleksi şekillenmesi sağlanır. Yıkama işleminin ardından enzimle işaretli antijen veya antikor ilave edilir. İşaretlemede kullanılan enzime özgü substratın ilavesi sonucu reaksiyon şekillenmesiyle elde edilen renkli ürünlerin absorbansı ölçülerek aranılan antijen veya antikorun miktarı belirlenmiş olur.
ELISA çeşitleri aşağıdaki gibi gruplar altında incelenebilmektedir.
- Yarışmalı teknikler
- Antijen-enzim konjugatını kullanan teknik
- Antikor-enzim konjugatını kullanan teknik
- Yarışmalı olmayan teknikler
- Çift antikor sandviç tekniği
- Modifiye çift antikor sandviç tekniği
- İndirekt teknik
Radyoimmunoassay (RIA) ile 50 çeşitten fazla analitin ölçümü yapılmaktadır. RIA terimi, izotopların kullanıldığı her analiz için yanlış olarak kullanılmaktadır. Aslında bunlar radyoligand yöntem adı altında toplanmaktadır. Başlıca radyoligand yöntemler;
- Radyoimmun yöntem (RIA)
- Immunoradimetrik yöntem (IRMA)
- Yarışmalı (kompetetif) protein bağlama (CPB) yöntemi
- Radyoreseptör analizi
- Radyoenzimatik yöntem
RIA, bir izotopla işaretli antijenin, işaretlenmemiş antijenle yarışmaya girerek antikorla bağlanmasına dayanır. IRMA yönteminde ise işaretli antijen yerine, saflaştırılmış ve işaretlenmiş antikor kullanılmaktadır. CPB, belirli bir antikor yerine belirli bir hormon veya hormon sınıfına özgül affinitesi olan doğal plazma proteinleri kullanılır.
Likit sintilasyon cihazı beta ışınlarını yayan izotopları ölçmek için kullanılmaktadır. ß-ışıması yapan ve sık kullanılan izotoplara örnek olarak 3H, 14C ve 22P verilebilir.
Gama sayaçlarının temel çalışma prensibi sıvı sintilasyon cihazlarına benzer. Gamma ışınlarının görülebilir ışınlara dönüştürülmesi amacıyla talyum içeren NaI kristalleri kullanılır. Kristal tarafından soğurulan ? ışınları talyumla aktive edilmiş NaI tarafından fotonlara dönüştürülür. Bu fotonlar sezyum elementinden üretilmiş katottaki ışığa duyarlı yüzey tarafından alınır ve absorbe edilen ışık fotonlarının sayısıyla orantılı olarak akım üretilir.
Polimeraz zincir reaksiyonu (PCR) tekniğinde kullanılan ayıraçların ağırlıklı kısmını gündelik kullanılan moleküler biyoloji ayıraçları oluşturur. Bu teknik sayesinde DNA molekülünün belirlenen bir bölümü çok fazla sayıda kopyalanır. Reaksiyon başlangıcında kalıp DNA molekülü çok düşük konsantrasyonda iken reaksiyonun ilerleyen aşamalarında dramatik olarak artar. Bir önceki siklusta ürün olarak meydana gelen DNA parçası bir sonraki aşamada kalıp görevi yapar. Reaksiyon esnasında kullanılan primer ve dNTP gibi moleküllerin derişimi fazla değişim göstermez iken DNA polimeraz sınırlayacı faktör olarak karşımıza çıkar.